1. WHO2023報告顯示
懷孕期間的細菌感染一直是產科難題。根據世界衛生組織(World Health Organization, WHO)2023年《世界衛生統計報告》,全球每年約20萬名新生兒死於孕產期感染併發症,遠高於因先天缺陷或分娩創傷的死亡人數。現階段主要依賴產前篩檢,如陰道群聚鏈球菌(Group B Streptococcus, GBS)篩檢與抗生素預防給藥,但仍有漏網之魚(Le Doare et al., 2016, Clin Infect Dis)。更棘手的是,胚胎在免疫系統尚未成熟前,父母和臨床醫師幾乎束手無策。細菌一旦穿過絨毛膜,就可能引發早產、胎兒腦炎等重症,影響終生發展。
市場上目前尚無針對「胚胎期」的主動防禦產品,多數治療集中在感染後的補救,缺乏前置保護策略;而母體廣泛用藥又存在胎兒潛在毒性風險(Siffert et al., 2020, J Perinat Med)。因此,科學家亟需釐清「胚胎自身是否具備微生物防禦能力?」以及「如何利用此能力降低產前感染率?」兩大問題,才能根本改善孕產期感染管理。
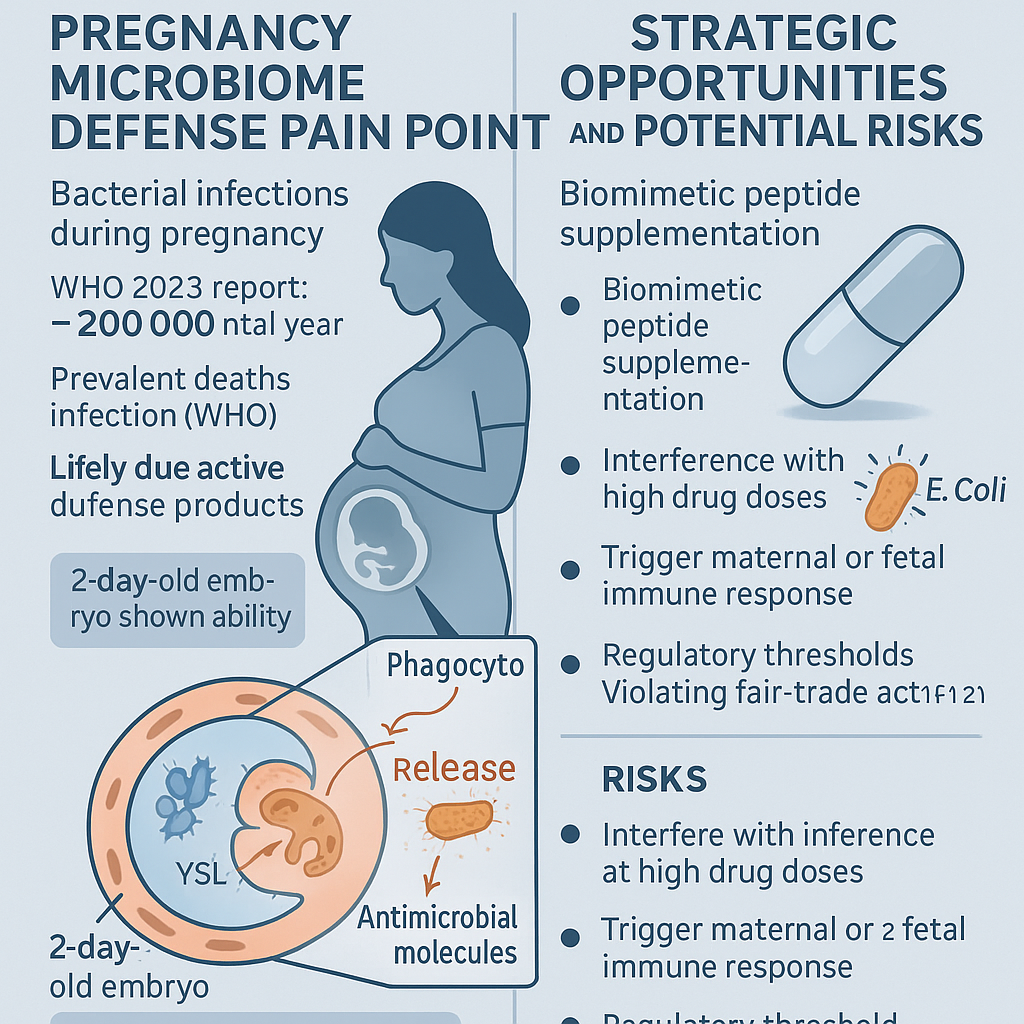
2. 2天齡胚胎顯示能力
由西班牙國家科學研究委員會(CSIC)巴塞隆納分子生物學研究所(IBMB)與貝爾維格生醫研究所(IDIBELL)合作團隊,最新發表於Cell Host & Microbe(2024)一文指出,斑馬魚(Danio rerio)胚胎在第2天齡就能攝取並消滅病原菌。研究者利用胚胎透明特性,結合活體螢光顯微攝影,高解析度拍攝到胚胎外層細胞將外來細菌吞噬,並在4 小時內分泌溶菌酶(lysozyme)及抗菌胜肽(antimicrobial peptides, AMPs)加速細菌死亡。
這項成果顛覆過去「胚胎無免疫能力」的既有印象。根據論文作者Garcia‐Mora et al.(2024)分析,胚胎利用位於卵黃層(yolk syncytial layer, YSL)的細胞群,先行表現多種先天免疫分子,包括肽醯基甘氨酸-甘氨酸-蘇氨酸(PGGTS)家族抗菌肽與補體成分C3。同時,Bajoghli等(2005, J Immunol)早前亦曾報導魚類早期胚胎的內吞機制,可作為此研究的機制基礎。
從成像資料可視化分析,當胚胎遭遇革蘭氏陽性或陰性菌株時,其胞膜區域出現局部凹陷,形似巨噬細胞(macrophage)的吞噬反應,隨後融合溶酶體釋放內容物,並結合胚胎內源抗菌蛋白質,加速細菌裂解。整個過程在胚胎自身免疫細胞發育(約第5天)前就已完成,顯示胚胎擁有獨立的第一道微生物防線。
3. 機會與風險並存評估
這項發現對生技產業與醫療決策者帶來新機遇:一方面,可朝「孕期補充型先天免疫增強」策略切入,開發仿生抗菌胜肽(synthetic AMPs)或母體口服補充劑,提升胚胎YSL層的抗菌能力。Gallo與Hooper(2012, Nat Rev Immunol)指出,AMPs在阻斷多重抗藥性菌株上展現潛力,若能借鏡胚胎自然機制,或可減少孕婦用藥負擔。
然而,早期胚胎介入也存四大風險:一、藥劑濃度過高可能干擾胚胎發育分化;二、外源AMPs易引發母體或胎兒免疫過度反應;三、法規門檻高,未經藥事法核准不得宣稱治療或預防功能;四、若未完整評估安全性,恐違反《公平交易法》第21條或《藥事法》第27條。特別是在台灣,任何未核准之保健或藥品宣稱都須謹慎,以免觸法(見《健康食品管理法》)。
建議生技新創可先從體外與動物模型試驗(preclinical study)切入,驗證低劑量AMPs在胚胎期的安全與功效,再透過法規路徑申請第I期(Phase I)臨床試驗。醫師與投資人宜密切留意各國GDPR與ICH E10指引,確保數據可跨境認可。最後,您認為,若要將胚胎自然防禦機制轉化為人用前置保護策略,最關鍵的挑戰會是什麼?